 Kinetická teória plynu
Kinetická teória plynu
Učebné ciele
Osvojiť si základné pojmy a poznatky, na ktorých sa buduje kinetická teória ideálneho plynu. Študent z týchto poznatkov má pochopiť odvodenie vzťahov pre tlak, energiu, prácu, voľnú dráhu a rozdelenie častíc plynu podľa ich rýchlostí. Taktiež má získať predstavu o prenosových javoch v ideálnom plyne.
Kľúčové slová
ideálny plyn, tlak plynu, vnútorná energia, tepelná kapacita, práca plynu, voľná dráha, stavová rovnica plynu, Mawellovo rozdelenie rýchlostí, prenosové javy
Predstavme si nádobu, v ktorej je plyn. Častice plynu obsadzujú nádobu rovnomerne. Ak si nádobu myslene rozdelíme na rovnaké oddelenia, ukáže sa, že v každom je približne rovnaký počet častíc plynu. Ukážka možného obsadenia nádoby s dvomi oddeleniami nás privádza k výsledku, že najpravdepodobnejšie obsadenie oddelení je N/2, kde N je celkový počet častíc v nádobe.
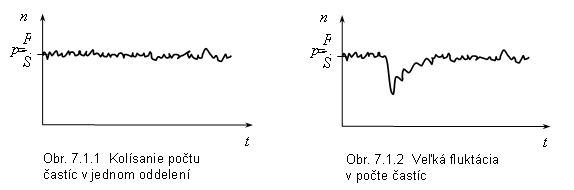
Pravdepodobnejšie sú také obsadenia oddelení, kde sa počty častíc v jednom oddelení blížia k N/2 (o tom by sme sa presvedčili zostavovaním tabuliek pre väčšie a väčšie N). Pre veľký počet častíc je rovnaké obsadenie oboch oddelení najpravdepodobnejšie, avšak nA = nB sa vyskytuje zriedkavo. Počet častíc v jednom oddelení jemne kolíše okolo hodnoty N/2. Na obr. 7.1.1 je ukázané toto kolísanie počtu častíc v jednom oddelení ako funkcia času. Toto jemné kolísanie hodnoty okolo najpravdepodobnejšej hodnoty nazývame fluktuáciami. Občas sa vyskytne výrazná fluktuácia, obr. 7.1.2. Plyn po takejto veľkej fluktuácii sa vráti späť do rovnovážneho stavu (kde je n = N/2) za určitú dobu, ktorú voláme relaxačnou dobou. Takéto výrazné fluktuácie môžeme zaznamenať. Napr. príčinou Brownovho pohybu (Brown sledoval pod mikroskopom peľové zrnko vo vode a zistil, že sa pohybuje nepravidelne a trhane) sú takéto fluktuácie. Na obr. 7.1.3 je ukázaná trajektória peľového zrnka. Príčinou tohto pohybu sú nárazy častíc prostredia (napr. molekúl H2O) na dostatočne malé teleso (napr. peľové zrnko). Ak v nejaký okamih výrazne prevládne počet molekúl narážajúcich na teleso z jednej strany (čo môžeme považovať za fluktuáciu), teleso sa týmto smerom pohne. Nárazy častíc prostredia majú pôvod v ich tepelnom pohybe, ktorý je chaotický. Preto Brownov pohyb telieska je tiež chaotický. Tento pohyb, ako ukázali pokusy, závisí od teploty: čím je teplota prostredia vyššia, tým je pohyb intenzívnejší. Iný dôkaz existencie tepelného pohybu molekúl vzduchu poskytujú fluktuácie nulovej polohy zrkadlového galvanometra (zrkadielko je upevnené na zvislom vlákne, ktoré je osou otáčania). Nerovnomernosť nárazov molekúl na pravú, alebo ľavú stranu zrkadielka spôsobuje jeho jemné otáčanie na obe strany. Graf uhlovej výchylky zrkadielka od času je podobný obr. 7.1.1.

V tejto úvodnej časti sme zistili z chovania sa častíc plynu, že hoci nemôžeme sledovať každú časticu osobitne, jestvuje rovnovážna hodnota veličiny, ktorá charakterizuje pohyb častíc. Táto veličina už má makroskopický charakter a môže byť merateľná. Nazýva sa koncentrácia častíc a vyjadruje počet častíc v jednotke objemu (hustota počtu častíc). V prípade uvedenom vyššie by sme zistili, že koncentrácia plynu (makroskopická veličina) je rovnaká v oboch oddeleniach nádoby. Kinetická teória plynu dáva do súvislosti makroskopické parametre plynu s veličinami charakterizujúcimi vlastnosti a pohyb jednotlivých častíc.
Kontrolné otázky
-
Pokús sa zostaviť tabuľku pre N = 4 a zistiť, aké obsadenie oddelení je najpravdepodobnejšie a aká je hodnota tejto pravdepodobnosti.
-
Počet elektrónov emitovaných horúcim povrchom kovu za jednotku času nie je prísne konštantný (pri ustálenej teplote kovu). Aký je pôvod týchto fluktuácií?
