 Maxwellovo rozdelenie molekúl podľa rýchlosti
Maxwellovo rozdelenie molekúl podľa rýchlosti
V plyne v dôsledku chaotického pohybu častíc a zrážok medzi nimi sa ustáli rovnovážny stav, ktorý sa prejavuje rovnomerným rozdelením teploty a koncentrácie častíc v nádobe. Jednotlivé častice sa pohybujú rôznymi smermi a môžu mať rôzne rýchlosti v. Pravdepodobnosť toho, že častica má rýchlosť v intervale hodnôt v až (v+dv) je úmerná (pozri § 7.1.7) exp(-W/kT). Plyn je ideálny, jeho častice nemajú potenciálnu energiu a nepredpokladáme existenciu vonkajšieho silového poľa. Potom z celkovej mechanickej energie častice ostáva len kinetická energia. Ak je N počet všetkých častíc v objeme, potom dN je počet častíc s rýchlosťami v uvedenom intervale. Ak by sme kreslili pre jednotlivé častice (ktoré majú rýchlosť v rámci tohoto intervalu) ich vektory v z jedného bodu, tak ich konce by boli v guľovej vrstve s polomerom v a hrúbkou dv. Objem tejto vrstvy je 4pv2 dv. Počet častíc s takýmito rýchlosťami je úmerný celkovému počtu častíc v objeme, hrúbke guľovej vrstvy a pravdepodobnosti výskytu rýchlostí v intervale v až v+dv
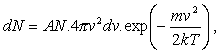 (a)
(a)kde A je koeficient úmernosti. Po výpočtoch prídeme k
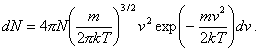 (7.1.22)
(7.1.22)Toto je Maxwellovo rozdelenie častíc plynu podľa rýchlostí. Vzťah nám udáva koľko častíc plynu má pri teplote plynu T rýchlosť v intervale od v do v+dv. Výraz
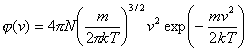 (7.1.23)
(7.1.23)je Maxwellova rozdeľovacia funkcia. Keďže kinetická energia častice plynu súvisí s jej rýchlosťou, je možné rozdelenie podľa rýchlostí prepočítať na rozdelenie podľa energií (príklad 7.1.8.3).
Hodnota najpravdepodobnejšej rýchlosti je
Výpočet najpravdepodobnejšej energie je v príklade 7.1.8.2.
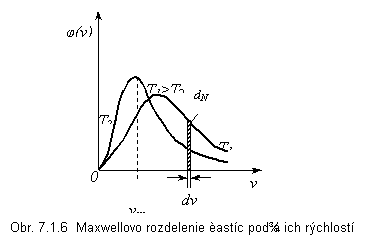
Grafické znázornenie Maxwellovej rozdeľovacej funkcie je na obr. 7.1.6. Plochy ohraničené krivkami a vodorovnou osou sú rovnaké a rovné počtu všetkých častíc N. Vo vyšrafovanom pásiku je dN častíc, ktoré majú rýchlosti od v do v+dv. Z grafu vidno, že pravdepodobnosť nulovej rýchlosti častice je nulová, čo znamená, že pri nijakej teplote sa nezastaví tepelný pohyb častíc plynu. Tiež vidíme, že čím je teplota plynu vyššia, tým sa závislosť stáva viac plochou a najpravdepodobnejšia rýchlosť nadobúda vyššie hodnoty, t.j. viac častíc má vysoké rýchlosti. Graf nie je symetrický, čo znamená, že najpravdepodobnejšia rýchlosť vm nebude totožná so strednou rýchlosťou v ani so strednou kvadratickou rýchlosťou vm. Najjednoduchšie je získať strednú kvadratickú rýchlosť zo (7.1.4):
a stredná rýchlosť (príklad 7.1.8.1)
Príklad 7.1.8.4
Predstavte si, že máme plyn, častice ktorého sa môžu pohybovať len v rovine (tzv. dvojrozmerný plyn). Odvoďte vzťah analogický vzťahu (7.1.22).
Riešenie
Postupujeme úplne rovnako ako v § 7.1.8, s tým rozdielom, že konce vektorov rýchlostí nebudú v guľovej vrstve, ale v medzikruží. Pri výpočte integrálu použijeme vzorec
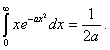
Výsledný vzťah je
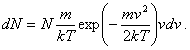
Kontrolné otázky
-
Zmení sa pomer vk : vm : vstredna pri zmene teploty?
-
Ktorá rýchlosť z týchto troch
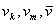 je najväčšia, ktorá je najmenšia? Ktorú rýchlosť má najviac častíc, ktorú má najmenej? Použite obr. 7.1.8.
je najväčšia, ktorá je najmenšia? Ktorú rýchlosť má najviac častíc, ktorú má najmenej? Použite obr. 7.1.8. -
Ak zväčšíme koncentráciu plynu, ako sa zmení pravdepodobnosť nájsť v plyne časticu s určitou rýchlosťou?
-
Ako by ste vypočítali najpravdepodobnejšiu energiu dvojrozmerného plynu? Použite príklady 7.1.8.3 a 7.1.8.4.
