 Atóm vodíka, Bohrov model atómu
Atóm vodíka, Bohrov model atómu
Atóm vodíka je najjednoduchší atóm, skladajúci sa z jedného elektrónu a jedného protónu, viazanými elektrostatickou interakciou. Z experimentov bolo známe, že atóm nežiari, ak sa nachádza v základnom stave, t.j. v stave s najnižšou energiou. Ak však zvýšime jeho vnútornú energiu, atóm sa dostane do excitovaného stavu, t.j. do stavu s energiou nad základným stavom. Atóm v excitovanom stave vysiela žiarenie.
Bohrov model atómu
Na sklonku devätnásteho storočia bolo zistené, že spektrum atómov môže byť tvorené radom diskrétnych hodnôt frekvencií, vtedy hovoríme očiarovom spektre. Najjednoduchšie spektrum odpovedá atómu vodíka. Spektrálne čiary v atómových spektrách nie sú rozložené náhodile, ale sa radia do istých skupín, nazývaných spektrálne série. Vlnové dĺžky prislúchajúce jednotlivým pozorovaným čiaram v každej sérii, možno určiť jednoduchým empirickým vzorcom, pričom je nápadná podobnosť medzi jednotlivými vzorcami pre rôzne série, ktoré obsahujú úplné spektrum uvažovaného prvku.
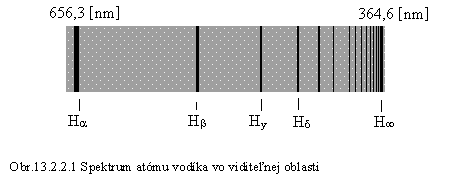
Prvá takáto séria, objavená vo viditeľnej časti spektra atómu vodíka a pozostávajúca zo štyroch čiar (obr. 13.2.2.1), sa nazýva Balmerova séria, podľa švajčiarskeho vedca, ktorý v roku 1885 vyjadril vlnové dĺžky tejto série vzorcom
![]() (13.2.2.1)
(13.2.2.1)
kde C je určitá konštanta a s = 3, 4, ... . Neskoršie Rydberg zistil, že Balmerov vzorec možno upraviť, po zavedení vlnočtu![]() n =1/l , na tvar
n =1/l , na tvar
![]() (13.2.2.2)
(13.2.2.2)
kde R je Rydbergova konštanta (resp. vlnočet ) pre vodík, ktorej hodnota je
R = 10 973 730 m-1 (13.2.2.3)
Postupne boli v spektre vodíka zistené i ďalšie série a to v infračervenej i v ultrafialovej oblasti spektra (obr. 13.2.2.2).

Vysvetliť pozorované čiarové spektrá atómu vodíka sa podarilo dánskemu fyzikovi Nielsovi Bohrovi (1885-1962), na základe poznatkov týkajúcich matematického vyjadrenia vlnočtov spektrálnych sérií [Balmerov (13.2.2.1) resp. Rydbergov vzorec (13.2.2.2)], poznatkov Planckovej teórie žiarenia zahriatych telies a Einsteinovej teórie fotoefektu.
Teóriu atómu vodíka zhrnul do troch postulátov:
1. Bohrov postulát stacionárnych stavov
Atómy môžu existovať v istých stacionárnych stavoch, v ktorých nevyžarujú energiu. Tieto stacionárne stavy korešpondujú „orbitám“ v klasickej predstave pohybujúcich sa elektrónov okolo jadra, obdobne ako predpokladal planetárny model atómu. Elektróny na týchto orbitách neemitujú elektromagnetické žiarenie i napriek tomu, že konajú pohyb so zrýchlením.
2. Bohrov postulát kvantovania orbitálnych dráh
Celkový orbitálny moment hybnosti elektrónu ln nachádzajúceho sa na stacionárnej orbite sa rovná celočíselnému násobku Planckovej konštanty h, resp. redukovanej Planckovej konštanty h = h/2p ( nazvanej hatrans).
![]() (13.2.2.4 )
(13.2.2.4 )
kde rn je polomer n-tej kruhovej dráhy (orbity) a n je prirodzené číslo.
3. Bohrov postulát frekvenčnej podmienky
Atóm emituje kvantum elektromagnetického žiarenia (fotón), keď elektrón preskočí z kvantovej dráhy s kvantovým číslom m na kvantovú dráhu s menším číslom n . Energia fotónu je určená rozdielom energií na kvantovej dráhe pred a po vyžiarení:
E = hf = Em - En (13.2.2.5)
Bohrove postuláty nemožno odvodiť z klasickej fyziky. Možno ich vysvetliť len na základe kvantovej mechaniky. Bohrov model určuje:
1/ vzťah pre energiu elektrónu na stacionárnej dráhe v atóme vodíka
![]() (13.2.2.6)
(13.2.2.6)
kde e0 je permitivita vákua, me hmotnosť elektrónu, Z je protónové číslo a n hlavné kvantové číslo. (Pre atóm vodíka platí Z = 1.)
Pre základný stav (n =1) možno určiť energiu základného stavu E1, ktorá má hodnotu E1= – 13,6 eV.
Poznámka: Rovnica (13.2.2.6 -13.2.2.8) platí aj pre atómu vodíka podobné atómy, t.j. ionizované atómy, ktoré majú 1 valenčný elektrón, ako napr. Li+...
2/ polomer n-tej kruhovej dráhy
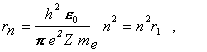 (13.2.2.7)
(13.2.2.7)
odvodený z podmienky, že dostredivá sila je spôsobená coulombickým priťahovaním elektrónu k jadru: t.j. platí ½fd½ = ½fc½
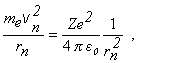 (13.2.2.8)
(13.2.2.8)
s využitím kvantovej podmienky vzťah (13.2.2.4).
Polomer orbity s hlavným kvantovým číslom n = 1 sa nazýva Bohrov polomer, r1 = 0,529177249 .10-10 m.
3/ frekvencie v čiarovom spektre vodíka
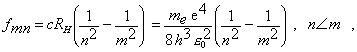 (13.2.2.9)
(13.2.2.9)
kde c je rýchlosť svetla , RH Rydbergova konštanta pre H-atóm a n, m sú prirodzené čísla.
RH = 1,0967758.107 m-1. Ak m =µ dostávame hranu série pre dané n.
Potvrdenie správnosti Bohrovho modelu:
· pomerne dobrý súhlas hodnoty Rydbergovej konštanty RH, určenej zo spektier a vypočítanej z Bohrovho modelu R¥. Nepatrný rozdiel vyplýva z predpokladu nehybného jadra (t.j. nekonečne ťažkého jadra). Ak zvážime, že protón má konečnú hmotnosť, je nutné do vzťahu miesto hmotnosti elektrónu me dosadiť redukovanú hmotnosť mred , definovanú vzťahom
![]()
![]()
· Franckov a Hertzov pokus, uskutočnený v roku 1913, ktorý experimentálne dokázal existenciu diskrétnych energetických hladín urýchľovaním elektrónov atómov ortuti vo vákuovej trubici.
Príklad 13.2.2.1 Na základe Bohrovej teórie atómu vodíka odvoďte vzťah pre polomer dráhy, rýchlosť na n-tej kvantovej dráhe v atóme vodíka. Určite hodnoty uvedených veličín pre tretiu kvantovú dráhu.
Riešenie Na základe Bohrovej teórie sa elektrón pohybuje po dovolených kruhových orbitách okolo jadra pod vplyvom Coulombovej príťažlivej sily medzi elektrónom a kladne nabitým jadrom. Podmienkou pre stabilitu pohybu je rovnosť veľkosti sily dostredivej a elektrostatickej , t.j. platí rovnica (13.2.2.8)
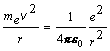 (1)
(1)
Dovolené orbity sú určené kvantovou podmienkou (13.2.2.4) mv rn = n h/2p . Ak si z uvedených rovníc vyjadríme kvadrát rýchlosti, resp. rýchlosť, dostaneme nasledovné rovnice
![]() , (2)
, (2)
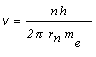 . (3)
. (3)
Umocnením rovnice (3) na druhú a porovnaním obidvoch pravých strán rovníc (2) a (3) dostávame vzťah (13.2.2.7) pre polomer dráhy
![]() . (4)
. (4)
V prípade n = 3 pre číselnú hodnotu polomeru tretej orbity dostaneme rn = 47,619.10-11 m. Obvodovú rýchlosť elektrónu na n-tej dráhe určíme z kvantovej podmienky (13.2.2.4)
![]() , (5)
, (5)
po dosadení za polomer z rovnice (4) a následných úpravách dostávame
![]()
![]()
a dosadení číselných hodnôt určíme obvodovú rýchlosť elektrónu na tretej sfére
v 3 = 7,2.105 m. s-1.
Príklad 13.2.2.2 Vypočítajte frekvenciu žiarenia potrebného na excitáciu elektrónu vo vodíkovom atóme zo základného stavu do najbližšieho excitovaného stavu.
Riešenie Druhý Bohrov postulát ukazuje, že ak elektrón preskočí z jednej dovolenej orbity s hlavným kvantovým číslom nm na druhú orbitu s hlavným kvantovým číslom nn , (m > n) emituje fotón frekvencie fmn určenej vzťahom (13.2.2.9)
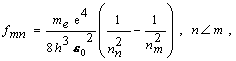
resp. fotón s vlnovou dĺžkou l určenou rovnicou
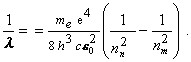
Keďže chceme dosiahnuť prechod z prvého excitovaného stavu nm =2 do základného stavu s nn =1 musíme atóm ožiariť s frekvenciou f
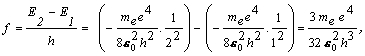
resp. jednoduchšie ak uvážime, že E1 = -13,6 eV a E2 = E1/4 , pre f dostaneme
f =( E2 - E1)/h = 3(13.6 eV)/4h =2,466.1015 Hz .
Príklad 13.2.2.3 Vypočítajte frekvenciu žiarenia potrebného na ionizáciu atómu vodíka v základnom stave. Akú „farbu“ budú mať tieto fotóny? Porovnajte ich s „farbou“ žiarenia potrebného na excitáciu do prvej vzbudenej hladiny. (Pozri príklad 13.2.2.2).
Riešenie Aby došlo k ionizácií atómu vodíka, musíme elektrónu dodať energiu, ktorá sa rovná½E1½, t.j. 13,6 eV Vtedy sa elektrón uvoľní z atómu. Frekvenciu žiarenia, spôsobujúceho ionizáciu atómu vodíka určuje vzťah (13.2.2.9) , kde sme dosadili n n= 1 a nm =µ
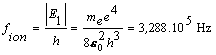
„Farba“ fotónom je priradená iba vo viditeľnej oblasti elektromagnetického spektra. Zistíme odpovedajúce vlnové dĺžky žiarenia, spôsobujúce ionizáciu i emisiu z prvej excitovanej hladiny na základnú. Prepočítaním cez rýchlosť svetla dostaneme vlnové dĺžky a to
![]() ,
,
![]()
Príklad 13.2.2.4 Na základe Bohrovho modelu atómu odvoďte vzťah pre celkovú energiu elektrónu v atóme vodíka nachádzajúceho sa na kruhovej dráhy s hlavným kvantovým číslom n.
Riešenie Celkovú energiu si vyjadríme ako súčet kinetickej a potenciálnej energie elektrónu na orbite s hlavným kvantovým číslom n.
En = Ekn +Epn .
Ekn určíme na základe vzťahu (2) z príkladu 13.2.2.1. Pre potenciálnu energiu v poli jadra s nábojom Ze v mieste s rn dostávame
![]()
![]()
Po dosadení vzťahu (4) z príkladu 13.2.2.1 za polomer rn, dostaneme pre celkovú energiu
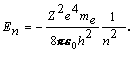
Kontrolné otázky
- Dokážte súvislosť medzi Rydbergovou konštantou vystupujúcou v Rydbergovej rovnici (13.2.2.2) a konštantou, nachádzajúcou sa vo vzťahu pre diskrétne hodnoty energie (13.2.2.6) atómu vodíka.
- Definujte pojem „redukovaná hmotnosť“.
- Zmenia sa energetické hladiny atómu vodíka, ak pohyb jadra nezanedbávame? Ak áno, ako?
- Napíšte vzťah pre vlnové dĺžky prechodov v Lymannovej sérii.
- Aké série boli pozorované v infračervenej oblasti spektra?
- Vo viditeľnej časti spektra atómu vodíka boli pozorované spektrálne čiary. Ich vlnovú dĺžku možno určiť na základe matematického vzťahu. Napíšte tento vzťah a meno objaviteľa tejto série.
- Definujte pojem hrana série.
- Definujte pojem základný stav atómu.
- Vysvetlite pojem „excitovaný stav atómu“.
- Aká energia, vyjadrená v eV, prináleží základnému stavu atómu vodíka?
- Vyjadrite energiu elektrónu v atóme vodíka ako funkciu hlavného kvantového čísla a energie základného stavu.
- Vyjadrite periódu obehu elektrónu v atóme vodíka, ako funkciu hlavného kvantového čísla.
- Vyjadrite potenciálnu a kinetickú energiu elektrónu na orbite s hlavným kvantovým číslom n ako funkciu polomeru tejto dráhy, resp. ako funkciu hlavného kvantového čísla.
- V akom vzťahu je Planckova konštanta k redukovanej Planckovej konštante (hatrans)?
- Vysvetlite pojem Bohrov polomer a určite jeho veľkosť.
- Napíšte vzťah určujúci polomer n-tej dráhy ako funkciu Bohrovho polomeru a hlavného kvantového čísla.
- Zistite, či sa prekrývajú niektoré z prvých šiestich energetických hladín elektrónu v atóme ionizovaného hélia He+ s energetickými hladinami elektrónu v atóme vodíka.
